En el siguiente informe, daré a conocer conceptos sobre reactivo limite y rendimiento; aplicándolos en formulas y/o ecuaciones trabajadas a lo largo de este.
A través de las paginas de este informe, presentare información elemental, explicaciones sencillas importantes y básicas del tema mencionado. Recordando que la mejor manera de tener un aprendizaje significativo es practicando la teoría, para así mismo llevar a cabo nuestra experiencia en el amplio espacio de la química.
OBJETIVOS
- OBJETIVO GENERAL
- OBJETIVOS ESPECIFICOS
- Reconocer formulas teniendo en cuenta el material que se dara en este informe.
MARCO TEÓRICO
La parte de la química que se encarga del estudio cuantitativo de los reactivos y productos que participan en una reacción se llama estequiometría. La palabra estequiometría deriva de dos palabras griegas: stoicheion, que significa elemento, y metron que significa medida.
La cantidad de reactivos y productos que participan en una reacción química se puede expresar en unidades de masa, de volumen o de cantidad de sustancia. Sin embargo, para hacer cálculos en una reacción química es más conveniente utilizar la cantidad de sustancia.
Los coeficientes estequiométricos obtenidos al balancear la ecuación química, nos permiten conocer la cantidad de productos a partir de cierta cantidad de reactivos, o viceversa. Para poder trabajar con la ecuación química, definimos las relaciones estequiométricas o factores de conversión que expresan un parámetro constante y universal para cada par de participantes en la reacción. Estas relaciones se obtienen a partir de la ecuación química balanceada y se fundamentan, lógicamente, en la ley de las proporciones definidas.
CO2(g) + NaOH(s) → Na2CO3(s) + H2O
Se estima que en 24 horas, un astronauta exhala aproximadamente 1000 g de CO2. ¿Cuántos kilogramos de NaOH se requieren para eliminar el CO2 exhalado por el astronauta? ¿Cuántos kg de Na2CO3 se producen en el proceso?
Ecuación química balanceada:
CO2(g) + 2 NaOH(s) → Na2CO3(s) + H2O
1 mol 2mol 1 mol 1 mol
44.0 g 2(40.0 g) 106 g 18 g
44.0 g 2(40.0 g) 106 g 18 g
Relaciones estequiométricas en masa:
Relaciones estequiométricas en mol:
- REACTIVO LIMITE
En una reacción química, para determinar cual de los reactivos es el limitante, se pueden usar los siguientes métodos:
- Se supone que un reactivo se consume por completo, se puede calcular la cantidad del segundo reactivo que se requiere en la reaccion. Si se compara la cantidad calculada con la disponible, se puede determinar cual es el reactivo limitante.
- Se puede calcular la cantidad de producto que podría formarse a partir de cada una de las cantidades dadas de el reactivo, suponiendo que se consumiera totalmente. El reactivo que conduzca a la cantidad de producto mas pequeña sera el reactivo limitante.
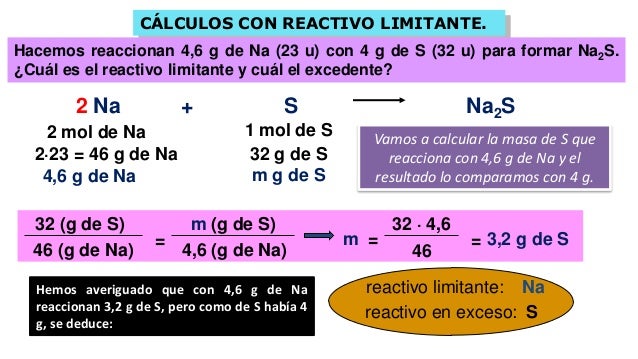
- Ejemplo:
MnO2 (s) + 4 HCl (ac) → MnCl2 (ac) + Cl2 (g) + 2 H2O (l)
Al inicio se ponen a reaccionar 4.5 g de MnO2 con 4.0 g de HCl. ¿Cuántos gramos de Cl2 se obtienen? Calcular la cantidad de reactivo en exceso que queda sin reaccionar.
En adelante se usará el método de relaciones estequiométricas, expresadas en mol, para todos los cálculos estequiométricos.
MnO2 (s) + 4 HCl (ac) → MnCl2 (ac) + Cl2 (g) + 2 H2O (l)
1 mol 4 mol 1 mol 1 mol 2 mol
Para determinar cuál es el reactivo límite, se dividen las mol de cada reactivo entre el respectivo coeficiente estequiométrico. El menor valor obtenido para este cociente corresponde al reactivo límite:
Todos los cálculos estequiométricos deben hacerse tomando como referencia al reactivo límite:
- RENDIMIENTO Y PUREZA DE UNA REACCION
Rendimiento(%)= rendimiento exp (g) x 100
---------------------------
rendimiento teorico (g)
Donde:
- Rendimiento teorico: Es la máxima cantidad de productos que podemos obtener de una reacción quíimica. 3 Pureza y rendimiento.
- Rendimiento real: Es la cantidad cantidad de producto producto que se obtiene obtiene realmente realmente de una reacción química, que siempre es menor que el rendimiento teórico.
- Ejemplo:
- La reacción de 6,8 g de H2S con exceso de SO2, según la siguiente reacción, produce 8,2 g de S. ¿Cual es el rendimiento?
(Pesos Atómicos: H = 1,008, S = 32,06, O = 16,00).En esta reacción, 2 moles de H2S reaccionan para dar 3 moles de S.1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6,8 g de H2S.(6,8/34) x (3/2) x 32 = 9,6 g 2) Se divide la cantidad real de S obtenida por la máxima teórica, y se multiplica por 100.(8,2/9,6) x 100 = 85,4%
- PUREZA
impurezas, es decir, que parte de los reactivos son sustancias que no reaccionaran en la reaccion que estamos estudiando. Para diferenciar la parte del reactivo que si
reaccionara (parte pura) de que no (parte impura) se define el porcentaje de pureza: Ejemplo: una sustancia con un 90% de pureza, tiene en cada 100g totales de sustancia, 90g de sustancia pura y 10g de impura.
Porcentaje de pureza (%): Es la cantidad de sustancia pura en 100 parte de la
Porcentaje de pureza (%): Es la cantidad de sustancia pura en 100 parte de la
muestra.
WEBGRAFIA
g de la sustancia pura
% de pureza = ----------------------------------- X 100
g de la muestra
% de pureza = ----------------------------------- X 100
g de la muestra
En muchos casos, para llevar a cabo una reacción
química, no se cuenta con los reactivos puros.
Los materiales de partida están acompañados de impurezas; esto
es particularmente cierto en los procesos industriales. Antes de hacer los calculos
estequiometricos en estas reacciones, es preciso calcular la cantidad de reactivo puro
que existe, ya que en las reacciones quimicas suponen combinaciones entre
sustancias completamente puras.


- CONCEPTOS CLAVES E IMPORTANTES:
Reactivo limitante
Es aquel reactivo concreto de entre los que participan en una reacción cuya cantidad determina la cantidad máxima de producto que puede formarse en la reacción.
Es aquel reactivo concreto de entre los que participan en una reacción cuya cantidad determina la cantidad máxima de producto que puede formarse en la reacción.
Proporción de reacción
Cantidades relativas de reactivos y productos que intervienen en una reacción. Esta proporción puede expresarse en moles, milimoles o masas.
Cantidades relativas de reactivos y productos que intervienen en una reacción. Esta proporción puede expresarse en moles, milimoles o masas.
Rendimiento real
Cantidad de producto puro que se obtiene en realidad de una reacción dada. Compárese con rendimiento teórico.
Cantidad de producto puro que se obtiene en realidad de una reacción dada. Compárese con rendimiento teórico.
Rendimiento teórico
Cantidad máxima de un producto específico que se puede obtener a partir de determinadas cantidades de reactivos, suponiendo que el reactivo limitante se consume en su totalidad siempre que ocurra una sola reacción y se recupere totalmente el producto. Compárese con rendimiento.
Cantidad máxima de un producto específico que se puede obtener a partir de determinadas cantidades de reactivos, suponiendo que el reactivo limitante se consume en su totalidad siempre que ocurra una sola reacción y se recupere totalmente el producto. Compárese con rendimiento.
Rendimiento porcentual
Rendimiento real multiplicado por 100 y dividido por el rendimiento teórico.
Rendimiento real multiplicado por 100 y dividido por el rendimiento teórico.
Porcentaje de pureza
El porcentaje de un compuesto o elemento específico en una muestra impura.
El porcentaje de un compuesto o elemento específico en una muestra impura.
Modificaciones alotrópicas (alótropos)
Formas diferentes del mismo elemento en el mismo estado físico.
Formas diferentes del mismo elemento en el mismo estado físico.
Mol: Es el peso molecular de un compuesto expresado en gramos, por ejemplo la molécula de agua tiene un peso molecular de 18, o sea que el mol del agua es de 18 gramos.
Peso molecular: Es la suma de los pesos atómicos que entran en la formula molecular de un compuesto.
PROCEDIMIENTO
Se accede a la siguiente pagina: http://www.eis.uva.es/~qgintro/esteq/esteq.html
Escogemos la opcion numero 4 " reactivo limitante y rendimiento"
Observamos los ejercicios interactivos propuestos por la pagina
- SOLUCION ACTIVIDAD
- RESULTADOS ACTIVIDAD
- PROCESO DE SOLUCIÓN DE EJERCICIOS:
http://definicion.de/pureza/
http://www.eis.uva.es/~qgintro/esteq/esteq.html












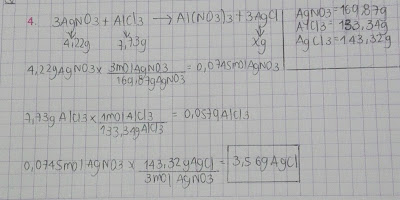



Faltó mas marco teórico y donde están resueltos los ejercicios 3.3
ResponderEliminarNIVELACION BUEN TRABAJO 5.0
ResponderEliminar